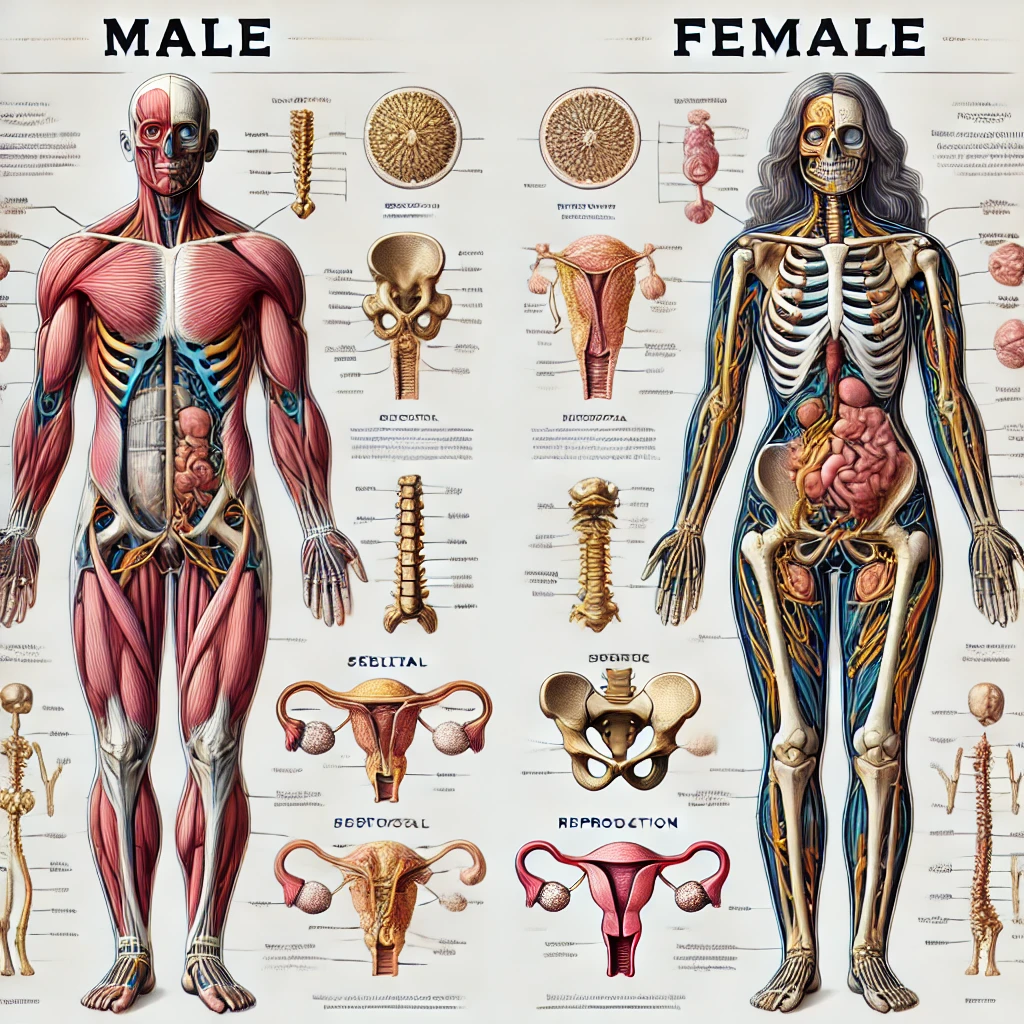
Amici, oggi ci inoltriamo in un viaggio affascinante, un’esplorazione che ci porta al cuore stesso di ciò che significa essere uomo o donna. Spesso, quando pensiamo alle differenze tra i sessi, ci vengono in mente immagini immediate: la forza fisica, la dolcezza materna, o magari certi stereotipi che la società ci propina. Ma la realtà, come sempre, è molto più complessa e ricca di sfumature. E la scienza, come un’instancabile esploratrice, continua a svelarci nuovi segreti su questo tema antico come l’umanità.
Proprio recentemente, ad esempio, uno studio pubblicato sulla prestigiosa rivista “Nature” (e qui potremmo inserire il link all’articolo) ha evidenziato come il cervello femminile, in media, risulti più “giovane” di quello maschile di circa tre anni. Questa differenza, misurata attraverso sofisticate tecniche di neuroimaging, potrebbe spiegare perché le donne, in generale, mantengono più a lungo le proprie capacità cognitive con l’avanzare dell’età. Un dato affascinante, non trovate?
Il nostro viaggio inizia dal codice della vita, il DNA. Sapete, i cromosomi X e Y non si limitano a determinare se nasceremo maschi o femmine. Come minuscoli direttori d’orchestra, guidano un’intera sinfonia di geni, influenzando lo sviluppo del nostro corpo e del nostro cervello. E poi ci sono gli ormoni, messaggeri chimici che scorrono nel nostro sangue, plasmando ogni aspetto della nostra esistenza. Pensate al testosterone, che non solo scolpisce i muscoli, ma accende anche la passione e l’aggressività. A questo proposito, sapevate che, secondo una ricerca del “New York Times” (link all’articolo), i livelli di testosterone negli uomini occidentali sono in calo negli ultimi decenni? Un fenomeno che potrebbe avere diverse cause, dall’inquinamento all’alimentazione, e che gli scienziati stanno ancora indagando.
O agli estrogeni, che orchestrano il ciclo femminile e proteggono il cuore. Ma attenzione: come riportato dal “Guardian” (link all’articolo), gli estrogeni non sono solo “ormoni femminili”. Giocano un ruolo importante anche nella salute degli uomini, influenzando la densità ossea e la funzione cardiovascolare.
Ma il vero mistero si cela nel cervello, la macchina più straordinaria dell’universo. Immaginate: due cervelli, apparentemente simili, ma con sottili differenze che si riflettono nel modo in cui uomini e donne percepiscono il mondo, risolvono i problemi, vivono le emozioni. L’amigdala, ad esempio, il centro delle emozioni, è più grande negli uomini, mentre l’ippocampo, scrigno dei ricordi, è più sviluppato nelle donne. E non dimentichiamo la serotonina, il neurotrasmettitore del buonumore, che viene prodotto a ritmi diversi nei due sessi. Uno studio della BBC (link all’articolo) ha addirittura suggerito che queste differenze nella serotonina potrebbero contribuire a spiegare perché le donne sono più soggette alla depressione rispetto agli uomini.
E che dire del sistema immunitario, il nostro esercito di difesa contro le malattie? Anche qui, le differenze sono sorprendenti. Le donne, grazie agli estrogeni, hanno difese più potenti, ma questo le rende anche più vulnerabili alle malattie autoimmuni, dove il corpo, quasi per errore, attacca se stesso. Un recente articolo del “National Geographic” (link all’articolo) ha esplorato questo tema, evidenziando come la ricerca stia facendo passi da gigante nella comprensione delle malattie autoimmuni, che colpiscono in modo sproporzionato le donne.
Amici, non dobbiamo cadere nell’errore di pensare a queste differenze come a una “guerra dei sessi”. Al contrario, esse rappresentano una meravigliosa complementarietà. Uomini e donne, con le loro peculiarità, si completano a vicenda, creando un’armonia che arricchisce la nostra specie.
Pensate alle implicazioni pratiche di queste scoperte. Una medicina personalizzata, che tenga conto delle differenze di genere, per curare meglio e prevenire le malattie. Un’educazione che insegni ai giovani il rispetto per la diversità, senza stereotipi e pregiudizi. E poi, le relazioni: comprendere le differenze tra uomo e donna ci aiuta a comunicare meglio, a costruire legami più forti e autentici.
In conclusione, amici, le differenze biologiche tra uomo e donna sono un tesoro da scoprire, un’opportunità per conoscere meglio noi stessi e gli altri. Non sono un limite, ma una ricchezza, un invito a celebrare la bellezza della diversità umana. E la scienza, come una guida esperta, ci accompagna in questo viaggio straordinario, svelandoci ogni giorno nuove meraviglie.
Riferimenti bibliografici
- Ngun, T. C., Ghahramani, N., Sánchez, F. J., Bocklandt, S., & Vilain, E. (2010). The genetics of sex differences in brain and behavior. Frontiers in Neuroendocrinology, 32(2), 227-246.
- Chaplin, D. D. (2010). Overview of the immune response. Journal of Allergy and Clinical Immunology, 125(2 Suppl 2), S3-S23.
- de Maat, M. P., Bladbjerg, E. M., Hjelmborg, J., Bathum, L., Jespersen, J., & Sørensen, T. I. (2011). Association between C-reactive protein and anthropometric measurements in a large population-based study. The American Journal of Clinical Nutrition, 93(5), 1055-1062.
- Bekkering, S., Arts, R. J., Novakovic, B., Kourtzelis, I., van der Heijden, C., Li, Y., … & Joosten, L. A. (2018). Metabolic induction of trained immunity through the mevalonate pathway. Cell, 172(1-2), 135-146. e9.
- Jentho, E., Novakovic, B., Ruiz-Moreno, C., Kourtzelis, I., Martins, R., Chavakis, T., … & Netea, M. G. (2019). Heme induces innate immune memory. bioRxiv, 2019-12.
- Ter Horst, R., Jaeger, M., Smeekens, S. P., Oosting, M., Swertz, M. A., Li, Y., … & Netea, M. G. (2016). Host and environmental factors influencing individual human cytokine responses. Cell, 167(4), 1111-1124. e13.
- Liu, T., Zhang, L., Joo, D., & Sun, S. C. (2017). NF-κB signaling in inflammation. Signal transduction and targeted therapy, 2(1), 1-9.
- Miraghazadeh, B., & Cook, M. C. (2018). Nuclear factor-κB in autoimmunity: man and mouse. Frontiers in immunology, 9, 613.
- Linowiecka, K., Urbanowska-Domańska, O., Guz, J., & Foksiński, M. (2019). The potential influence of breast cancer estrogen receptors’ distribution on active DNA demethylation. Contemporary oncology (Poznan, Poland), 23(2), 74-80.
- Jones, L. A., Kreem, S., Shweash, M., Paul, A., Alexander, J., & Roberts, C. W. (2010). Differential modulation of TLR3-and TLR4-mediated dendritic cell maturation and function by progesterone. The Journal of Immunology, 185(8), 4525-4534.
- Jones, L. A., Anthony, J. P., Henriquez, F. L., Lyons, R. E., Nickdel, M. B., Carter, K. C., … & Roberts, C. W. (2008). Toll-like receptor-4-mediated macrophage activation is differentially regulated by progesterone via the glucocorticoid and progesterone receptors. Immunology, 125(1), 59-69.
- Pergola, C., Pergola, C., Schaible, A. M., Nikels, F., Dodt, G., Northoff, H., … & Köse, C. (2015). Progesterone rapidly down-regulates the biosynthesis of 5-lipoxygenase products in human primary monocytes. Pharmacological research, 94, 42-50.
- Ma, W. T., Gao, F., Gu, K., & Chen, D. K. (2019). The Role of Monocytes and Macrophages in Autoimmune Diseases: A Comprehensive Review. Frontiers in immunology, 10, 1140.
- Gordon, S., & Plüddemann, A. (2014). Role of Macrophages in Autoimmunity. In The Autoimmune Diseases, Fifth Edition (pp. 161-174). Academic Press.
- Dulos, J., Vijn, P., van Doorn, C., Hofstra, C. L., Veening-Griffioen, D., de Graaf, J., … & van den Berg, T. (2010). Suppression of the inflammatory response in experimental arthritis is mediated via estrogen receptor alpha but not estrogen receptor beta. Arthritis research & therapy, 12(3), R101.
- Morales, L. B. J., Loo, K. K., Liu, H. B., Peterson, C., Tiwari-Woodruff, S., & Voskuhl, R. R. (2006). Treatment with an estrogen receptor α ligand is neuroprotective in experimental autoimmune encephalomyelitis. The Journal of Neuroscience, 26(25), 6823-6833.
- Harbuz, M. S., Perveen-Gill, Z., Lightman, S. L., & Jessop, D. S. (1995). A protective role for testosterone in adjuvant-induced arthritis. Rheumatology, 34(12), 1117-1122.
- Kanda, N., Tsuchida, T., & Tamaki, K. (1996). Testosterone inhibits immunoglobulin production by human peripheral blood mononuclear cells. Clinical & Experimental Immunology, 106(2), 410-415.
- Kanda, N., Tsuchida, T., & Tamaki, K. (1997). Testosterone suppresses anti-DNA antibody production in peripheral blood mononuclear cells from patients with systemic lupus erythematosus. Arthritis & Rheumatology, 40(9), 1703-1711.
- Vecchi, A. P., Borba, E. F., Bonfá, E., Cocuzza, M., Pieri, P., Kim, C. A., … & Pereira, R. M. (2011). Penile anthropometry in systemic lupus erythematosus patients. Lupus, 20(5), 512-518.
- Wei, T., & Lightman, S. L. (1997). The neuroendocrine axis in patients with multiple sclerosis. Brain, 120(6), 1067-1076.
- Safarinejad, M. R. (2008). Evaluation of endocrine profile, hypothalamic-pituitary-testis axis and semen quality in multiple sclerosis. Journal of neuroendocrinology, 20(12), 1368-1375.
- Baillargeon, J., Al Snih, S., Raji, M. A., Urban, R. J., Sharma, G., Sheffield-Moore, M., … & Volpi, E. (2016). Hypogonadism and the risk of rheumatic autoimmune disease. Clinical rheumatology, 35(12), 2983-2987.
- Chen, Y., Chen, Y., Xia, F., Wang, N., Chen, C., Nie, X., … & Zhao, Q. (2017). A higher ratio of estradiol to testosterone is associated with autoimmune thyroid disease in males. Thyroid, 27(7), 960-966.
- La-or, C., Wichai, A., & Boonsong, O. (2014). The relationship between circulating estradiol and thyroid autoimmunity in males. European journal of endocrinology, 170(1), 63-67.
- Kuznetsova, T., Prange, K. H., Glass, C. K., & de Winther, M. P. (2020). Transcriptional and epigenetic regulation of macrophages in atherosclerosis. Nature Reviews Cardiology, 17(4), 216-228.
- Novakovic, B., Habibi, E., Wang, S. Y., Arts, R. J., Davar, R., Megchelenbrink, W., … & Netea, M. G. (2016). β-Glucan reverses the epigenetic state of LPS-induced immunological tolerance. Cell, 167(5), 1354-1368. e14.
- Saeed, S., Quintin, J., Kerstens, H. H., Rao, N. A., Aghajanirefah, A., Matarese, F., … & Netea, M. G. (2014). Epigenetic programming of monocyte-to-macrophage differentiation and trained innate immunity. Science, 345(6204), 1251086.
- Almstrup, K., Lindhardt Johansen, M., Busch, A. S., Hagen, C. P., Nielsen, J. E., Petersen, J. H., … & Juul, A. (2016). Pubertal development in healthy children is mirrored by DNA methylation patterns in peripheral blood. Scientific reports, 6(1), 28657.
- Gruzieva, O., Merid, S. K., Chen, S., Mukherjee, N., Hedman, Å. M., Almqvist, C., … & Kull, I. (2019). DNA Methylation Trajectories During Pregnancy. Epigenetic insights, 12, 2516865719867090.
- Gomez-Lopez, N., Romero, R., Hassan, S. S., Bhatti, G., Berry, S. M., Kusanovic, J. P., … & Gomez, R. (2019). The Cellular Transcriptome in the Maternal Circulation During Normal Pregnancy: A Longitudinal Study. Frontiers in immunology, 10, 2863.
- Hong, S., Banchereau, R., Maslow, B. L., Guerra, M. M., Cardenas, J., Baisch, J., … & Pascual, V. (2019). Longitudinal profiling of human blood transcriptome in healthy and lupus pregnancy. The Journal of experimental medicine, 216(5), 1154-1169.
- Michalczyk, A. A., Janus, E. D., Judge, A., Ebeling, P. R., Best, J. D., Ackland, M. J., … & Davis, E. A. (2018). Transient epigenomic changes during pregnancy and early postpartum in women with and without type 2 diabetes. Epigenomics, 10(4), 419-431.
- Dvornyk, V., Liu, Y., Lu, Y., Shen, H., Lappe, J. M., Recker, R. R., … & Deng, H. W. (2007). Effect of menopause on gene expression profiles of circulating monocytes: a pilot in vivo microarray study. Journal of genetics and genomics, 34(11), 974-983.
- Bansal, A. S., Bora, S. A., Saso, S., Smith, J. R., Johnson, M. R., Thum, M. Y., … & David, A. L. (2012). Mechanism of human chorionic gonadotrophin-mediated immunomodulation in pregnancy. Expert review of clinical immunology, 8(8), 747-753.
- Reinhard, G., Noll, A., Schlebusch, H., Mallmann, P., & Ruecker, A. V. (1998). Shifts in the TH1/TH2 balance during human pregnancy correlate with apoptotic changes. Biochemical and biophysical research communications, 245(3), 933-938.
- Sykes, L., MacIntyre, D. A., Yap, X. J., Teoh, T. G., & Bennett, P. R. (2012). The Th1: th2 dichotomy of pregnancy and preterm labour. Mediators of inflammation, 2012.
- Tranchot-Diallo, J., Gras, G., Benveniste, O., MarcÉ, D., Roques, P., Dormont, D., … & Desgranges, C. (1997). Modulations of cytokine expression in pregnant women. American Journal of Reproductive Immunology, 37(3), 215-226.
- Szekeres-Bartho, J., Šućurović, S., & Mulac-Jeričević, B. (2018). The role of extracellular vesicles and PIBF in embryo-maternal immune-interactions. Frontiers in immunology, 9, 2890.
- Marzi, M., Vigano, A., Trabattoni, D., Villa, M. L., Salvaggio, A., Clerici, E., … & Galli, M. (1996). Characterization of type 1 and type 2 cytokine production profile in physiologic and pathologic human pregnancy. In Pregnancy (p. 127). Blackwell Scientific Publications.
- Shima, T., Sasaki, Y., Itoh, M., Nakashima, A., Ishii, N., Sugamura, K., … & Saito, S. (2010). Regulatory T cells are necessary for implantation and maintenance of early pregnancy but not late pregnancy in allogeneic mice. Journal of reproductive immunology, 85(2), 121-129.
- Shirshev, S. V., Orlova, E. G., Zamorina, S. A., & Nekrasova, I. V. (2011). Influence of reproductive hormones on the induction of CD4 (+) CD25 (bright) Foxp (3 +) regulatory T cells. Doklady biological sciences, 440, 343-346.
- Dauven, D., Ehrentraut, S., Langwisch, S., Zenclussen, A. C., & Schumacher, A. (2016). Immune Modulatory Effects of Human Chorionic Gonadotropin on Dendritic Cells Supporting Fetal Survival in Murine Pregnancy. Frontiers in endocrinology, 7, 146.
- Schumacher, A., Brachwitz, N., Sohr, S., Engeland, K., Langwisch, S., Dolaptchieva, M., … & Zenclussen, A. C. (2009). Human chorionic gonadotropin attracts regulatory T cells into the fetal-maternal interface during early human pregnancy. The Journal of Immunology, 182(9), 5488-5497.
- Silasi, M., You, Y., Simpson, S., Kaislasuo, J., Pal, L., Guller, S., … & Sharma, S. (2020). Human Chorionic Gonadotropin modulates CXCL10 Expression through Histone Methylation in human decidua. Scientific reports, 10(1), 5785.
- Lima, F., Buchanan, N. M., Khamashta, M. A., Kerslake, S., & Hughes, G. R. (1995). Obstetric outcome in systemic lupus erythematosus. Seminars in arthritis and rheumatism, 25(3), 184-192.
- Cortés-Hernández, J., Ordi-Ros, J., Paredes, F., Casellas, M., Castillo, F., & Vilardell-Tarres, M. (2002). Clinical predictors of fetal and maternal outcome in systemic lupus erythematosus: a prospective study of 103 pregnancies. Rheumatology, 41(6), 643-650.
- Kaczynski, P., Bauersachs, S., Baryla, M., Goryszewska, E., Muszak, J., Grzegorzewski, W. J., … & Ziecik, A. J. (2020). Estradiol-17b-Induced Changes in the Porcine Endometrial Transcriptome In Vivo. International journal of molecular sciences, 21(3), 890.
- Gambacciani, M., & Levancini, M. (2014). Hormone replacement therapy and the prevention of postmenopausal osteoporosis. Przeglad menopauzalny= Menopause review, 13(4), 213-220.
- Ronkainen, P. H., Pöllänen, E., Alén, M., Pitkänen, R., Puolakka, J., Kujala, U. M., … & Sipilä, S. (2010). Global gene expression profiles in skeletal muscle of monozygotic female twins discordant for hormone replacement therapy. Aging cell, 9(6), 1098-1110.
- Cheishvili, D., Parashar, S., Mahmood, N., Arakelian, A., Kremer, R., Goltzman, D., & Mitchell, G. A. (2018). Identification of an epigenetic signature of osteoporosis in blood DNA of postmenopausal women. Journal of bone and mineral research, 33(11), 1980-1989.
- Arnold, A. P., & Chen, X. (2009). What does the “four core genotypes” mouse model tell us about sex differences in the brain and other tissues?. Frontiers in neuroendocrinology, 30(1), 1-9.
- Burgoyne, P. S., & Arnold, A. P. (2016). A primer on the use of mouse models for identifying direct sex chromosome effects that cause sex differences in non-gonadal tissues. Biology of sex differences, 7(1), 1-11.
- Chen, X., McClusky, R., Chen, J., Beaven, S. W., Tontonoz, P., Arnold, A. P., & Lusis, A. J. (2012). The number of x chromosomes causes sex differences in adiposity in mice. PLoS genetics, 8(5), e1002709.
- Vasconcelos, M. A., Sanches, F., & Francini, E. (2023). Androgens and the immune system: an intricate network with clinical implications. International Journal of Molecular Sciences, 24(7), 6302.
- Mendes, L. O., Castilho, A. C. S., Pinho, C. F., Gonçalvez, B. F., Razza, E. M., Chuffa, L. G. A., … & Martinez, F. E. (2018). Modulation of inflammatory and hormonal parameters in response to testosterone therapy: Effects on the ventral prostate of adult rats. Cell biology international, 42(9), 1200-1211.
- Lucas-Herald, A. K., & Touyz, R. M. (2022). Androgens and androgen receptors as determinants of vascular sex differences across the lifespan. Canadian Journal of Cardiology, 38(12), 1854-1864.
- Mantalaris, A., Panoskaltsis, N., Sakai, Y., Bourne, P., Chang, C., Messing, E. M., & Wu, J. H. (2001). Localization of androgen receptor expression in human bone marrow. The Journal of pathology, 193(3), 361-366.
- Chakraborty, B., Byemerwa, J., Krebs, T., Lim, F., Chang, C. Y., & McDonnell, D. P. (2023). Estrogen Receptor Signaling in the Immune System. Endocrine Reviews, 44(1), 117-141.
- Tang, Z. R., Zhang, R., Lian, Z. X., Deng, S. L., & Yu, K. (2019). Estrogen-receptor expression and function in female reproductive disease. Cells, 8(10), 1123.
- Walecki, M., Eisel, F., Klug, J., Baal, N., Paradowska-Dogan, A., Wahle, E., … & Meinhardt, A. (2015). Androgen receptor modulates Foxp3 expression in CD4+ CD25+ Foxp3+ regulatory T-cells. Molecular biology of the cell, 26(16), 2845-2857.
- Tang, Q., Cheng, B., Dai, R., & Wang, R. (2021). The Role of Androgen Receptor in Cross Talk Between Stromal Cells and Prostate Cancer Epithelial Cells. Frontiers in cell and developmental biology, 9, 729498.
- Morris, M. J., Mota, J. M., Lacuna, K., Hilden, P., Gleave, M., Carducci, M. A., … & Heller, G. (2021). Phase 3 Randomized Controlled Trial of Androgen Deprivation Therapy with or Without Docetaxel in High-risk Biochemically Recurrent Prostate Cancer After Surgery (TAX3503). European urology oncology, 4(4), 543-552.
- Ibáñez, L., Valls, C., & de Zegher, F. (2006). Discontinuous low-dose flutamide-metformin plus an oral or a transdermal contraceptive in patients with hyperinsulinaemic hyperandrogenism: Normalizing effects on CRP, TNF-alpha and the neutrophil/lymphocyte ratio. Human Reproduction, 21(2), 451-456.
- Dama, A., Baggio, C., Boscaro, C., & Albiero, M. (2021). Estrogen receptor functions and pathways at the vascular immune interface. International journal of molecular sciences, 22(8), 4254.
- McGlade, E. A., Miyamoto, A., & Winuthayanon, W. (2022). Progesterone and inflammatory response in the oviduct during physiological and pathological conditions. Cells, 11(7), 1075.
- Cioni, B., Zaalberg, A., van Beijnum, J. R., Melis, M. H., van Burgsteden, J., Muraro, M. J., … & van der Pluijm, G. (2020). Androgen receptor signalling in macrophages promotes TREM-1-mediated prostate cancer cell line migration and invasion. Nature communications, 11(1), 4498.
- Dressing, G. E., Goldberg, J. E., Charles, N. J., Schwertfeger, K. L., & Lange, C. A. (2011). Membrane progesterone receptor expression in mammalian tissues: a review of regulation and physiological implications. Steroids, 76(1-2), 11-17.
- Rabijewski, M., Papierska, L., Binkowska, M., Maksym, R., Jankowska, K., Skrzypulec-Plinta, W., & Zgliczynski, W. (2020). Supplementation of dehydroepiandrosterone (DHEA) in pre- and postmenopausal women—Position statement of expert panel of Polish Menopause and Andropause Society. Ginekologia polska, 91(9), 554-562.
- Mahajan, D., Sharma, N. R., Kancharla, S., Kolli, P., Tripathy, A., Sharma, A. K., … & Jena, M. K. (2022). Role of Natural Killer Cells during Pregnancy and Related Complications. Biomolecules, 12(1), 68.
- Artham, S., Chang, C. Y., & McDonnell, D. P. (2023). Eosinophilia in cancer and its regulation by sex hormones. Trends in Endocrinology & Metabolism, 34(1), 5-20.
- Similowski, T., Orcel, B., & Derenne, J. P. (1997). CD8+ lymphocytic pneumonitis in a patient receiving cyproterone acetate. Southern medical journal, 90(10), 1048-1049.
- Xiong, Y. L., Liang, X. Y., Yang, X., Li, Y., & Wei, L. N. (2011). Low-grade chronic inflammation in the peripheral blood and ovaries of women with polycystic ovarian syndrome. European Journal of Obstetrics & Gynecology and Reproductive Biology, 159(1), 148-150.
- Berghöfer, B., Frommer, T., Haley, G., Fink, L., Bein, G., & Hackstein, H. (2006). TLR7 ligands induce higher IFN-alpha production in females. The Journal of Immunology, 177(3), 2088-2096.
- Psarras, A., Alase, A., Antanaviciute, A., Carr, I. M., Md Yusof, M. Y., Wittmann, M., … & Vital, E. M. (2020). Functionally impaired plasmacytoid dendritic cells and non-haematopoietic sources of type I interferon characterize human autoimmunity. Nature communications, 11(1), 6149.
- Guéry, J. C. (2021). Sex Differences in Primary HIV Infection: Revisiting the Role of TLR7-Driven Type 1 IFN Production by Plasmacytoid Dendritic Cells in Women. Frontiers in immunology, 12, 729233.
- Wen, S., Wu, Z., Zhong, S., Li, M., & Shu, Y. (2021). Factors influencing the immunogenicity of influenza vaccines. Human vaccines & immunotherapeutics, 17(9), 2706-2718.
- **Lai, K. P., Lai, J. J., Chang, P., Altuwaijri, S., Hsu, J. W., Chuang, K. H., … & Chang, C. (2013). Targeting thymic epithelia AR enhances T-cell reconstitution and bone marrow transplant grafting efficacy. Molecular endocrinology, 27(